
必贝特成功登陆上交所科创板
2025-10-28
2025年10月28日,科创板科创成长层首批新注册企业上市仪式在上海证券交易所隆重举行。广州必贝特医药股份有限公司(股票名称:必贝特;股票代码:688759)在上海证券交易所科创板正式鸣锣

必贝特医药全球首创(First-in-Class)双靶点抗癌药BEBT-908获国家药监局批准上市
2025-07-02
2025年7月2日,必贝特医药(BeBetter Med)宣布其自主研发的全球首创(First-in-Class)HDAC/PI3Kα双靶点抑制剂BEBT-908(通用名称:注射用盐酸伊吡诺司他,商品名:贝特琳®)已正式获得中国国家药品
必贝特医药将在2025年JP Morgan会议-BIO合作平台展示新一代siRNA药物技术平台及临床前项目,寻求全球合作伙伴
2024-12-19
2024年12月19日,必贝特医药(BeBetter Med Inc.)宣布将通过其美国子公司必贝特药业(BeBetter Pharma Inc.)在2025年JP Morgan会议-BIO合作平台(BIO Partnering @ JPM Week)上展示自主研发的新一代siRNA药物技术
必贝特医药将在2025年JP Morgan会议-BIO合作平台展示BEBT-209治疗转移性三阴性乳腺癌II期临床中期试验结果
2024-12-19
必贝特医药(BeBetter Med Inc.)今日宣布,公司自主研发的创新药BEBT-209治疗转移性三阴性乳腺癌(mTNBC)II期临床中期试验结果将在2025年JP Morgan会议-BIO合作平台(BIO Partnering @ JPM Week)上展示。TNBC

BEBT-908治疗复发/难治性弥漫性大B细胞淋巴瘤进入确证性III期临床试验
2024-11-21
2024年11月21日,广州必贝特医药股份有限公司(以下简称“必贝特医药”)宣布,公司一类创新药BEBT-908联合利妥昔单抗(R)对比利妥昔单抗-吉西他滨-奥沙利铂(R-GemOx)或联合利妥昔单抗-异环
广州必贝特医药股份有限公司研发中试车间装修工程 环境影响报告书报批前公示
2024-10-29
根据《环境影响评价公众参与办法》(生态环境部令第4号)等的要求,建设单位向生态环境主管部门报批环境影响报告书前,应当通过网络平台,公开拟报批的环境影响报告书全文和公众参与
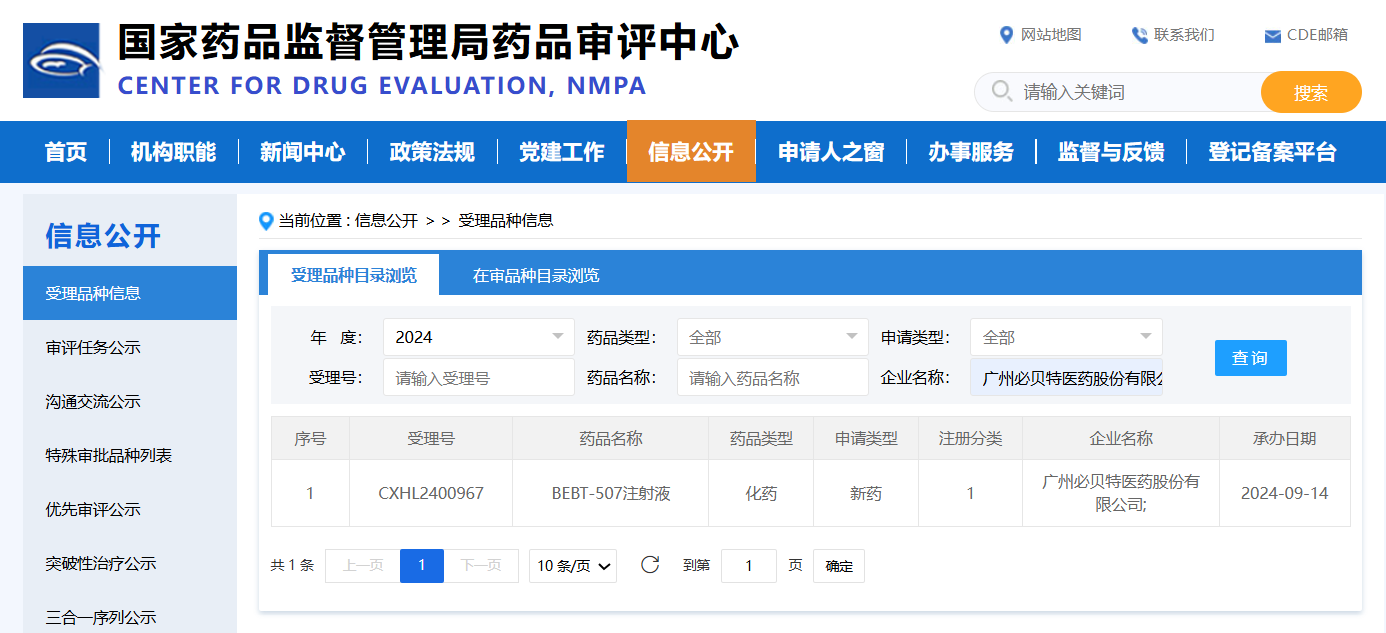
必贝特医药首款siRNA创新药BEBT-507临床试验申请获CDE受理
2024-09-14
2024年9月13日,广州必贝特医药股份有限公司自主研发的用于真性红细胞增多症的小核酸(siRNA)创新药“BEBT-507注射液”的临床试验申请(IND)已获得国家药品监督管理局药品审评中心(CDE)受
广州必贝特医药股份有限公司研发中试车间装修工程项目环境影响评价公众参与第二次公示
2023-11-16
根据《中华人民共和国环境影响评价法》及《环境影响评价公众参与办法》(生态环境部令第4号)等相关规定,现将环境影响评价事宜公告如下:一、环境影响报告书征求意见稿全文的网络链

BEBT-503在澳完成I期临床试验,必贝特持续推进国际合作
2023-10-31
近日,广州必贝特医药股份有限公司(以下简称“必贝特医药”)在澳大利亚成功完成了自主研发的泛PPAR激动剂一类新药BEBT-503的I期临床试验。该试验是一项在健康志愿者中开展的随机、双盲
必贝特医药泛突变型EGFR抑制剂BEBT-109 III期临床研究申请获CDE批准
2023-10-16
近日,广州必贝特医药股份有限公司泛突变型EGFR抑制剂BEBT-109获得中国国家药监局药品审评中心(CDE)批准同意开展二线治疗EGFR 20号外显子插入突变NSCLC的确证性III期临床试验。根据弗若斯特沙
必贝特医药First-in-Class新药双利司他NDA获受理
2023-10-09
2023年10月8日,广州必贝特医药股份有限公司自主研发的一类新药双利司他(BEBT-908)的新药上市申请(NDA)已获国家药品监督管理局药品审评中心(CDE)正式受理,用于既往接受过至少两种系统
广州必贝特医药股份有限公司研发中试车间装修工程项目环境影响评价公众参与第一次公示
2023-04-10
根据《中华人民共和国环境影响评价法》、《建设项目环境保护管理条例》、《建设项目环境影响评价分类管理名录》(2021年版)和《环境影响评价公众参与办法》(生态环境部令2018年第4号)
Copyright ©2018-2025 广州必贝特医药股份有限公司 版权所有粤ICP备18065301号
 粤公网安备44011202003231号
粤公网安备44011202003231号


