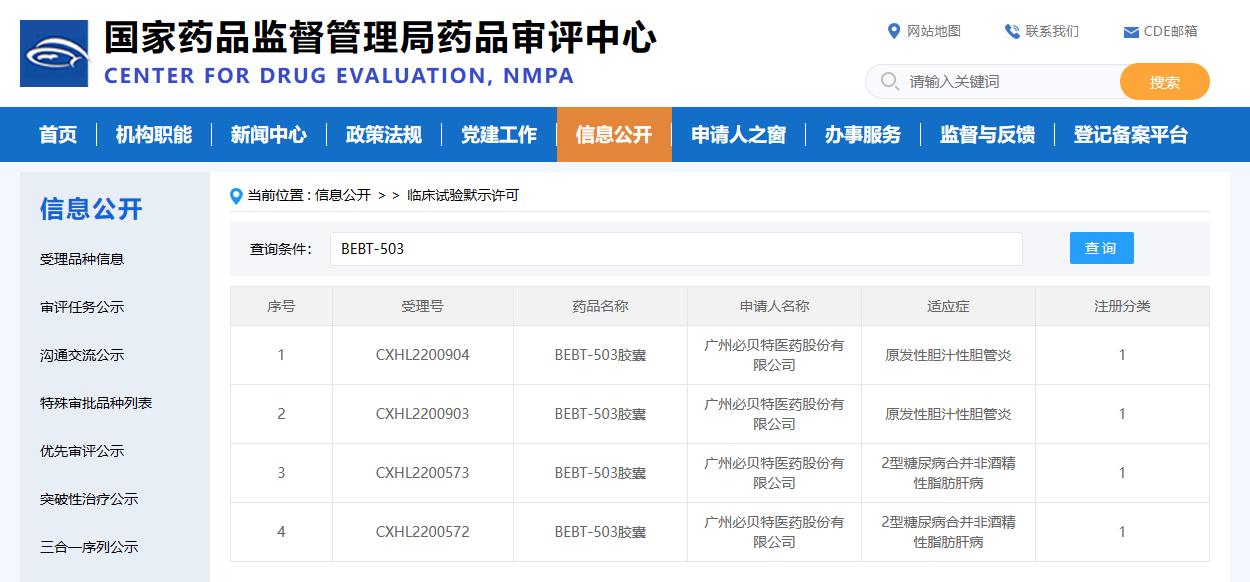
2023年02月03日,广州必贝特医药股份有限公司一类新药BEBT-503再获国家药品监督管理局批准在原发性胆汁性胆管炎(PBC)患者中开展随机、双盲、安慰剂对照的II期临床试验。此前,BEBT-503已于2022年10月26日获批开展治疗2型糖尿病合并非酒精性脂肪肝病的II期临床试验。
BEBT-503是必贝特医药设计开发的具有全球自主知识产权、结构新颖的化合物,是活性极强的泛PPARs激动剂,可有效、均衡地激活PPAR-α、PPAR-β、PPAR-γ三种亚型,调节关键代谢的信号通路,降低原发性胆汁性胆管炎的胆红素水平,减轻肝脏组织炎性细胞浸润、胆管增生和肝细胞坏死程度,抑制肝纤维化,在原发性胆汁性胆管炎和2型糖尿病合并非酒精性脂肪肝病等肝胆疾病中具有良好的治疗潜力。
原发性胆汁性胆管炎(PBC)是一种肝脏的自身免疫性疾病,可导致肝组织的不可逆损伤和瘢痕形成,最终需要肝移植,目前该疾病尚无治愈方法。根据文献报道,PBC在亚太地区的总体发病率为万分之1.19(95% CI 49.96-187.55),在中国的总体发病率相对较高,达到了万分之1.91。在大鼠PBC模型中BEBT-503可显著性降低血清中胆红素水平,显著性减轻肝脏组织炎细胞浸润、肝汇管区胆管增生以及肝细胞坏死程度,抑制肝纤维化。目前,BEBT-503已在澳大利亚开展I期临床试验,初步结果表明其安全性良好。预期BEBT-503将会给原发性胆汁性胆管炎尤其是对熊去氧胆酸应答不佳或无应答的PBC患者带来新的治疗选择。



 粤公网安备44011202003231号
粤公网安备44011202003231号