2020年广州必贝特医药技术有限公司创新药研发取得重大进展,正逐步成为国内自主研发一类新药的领头企业之一。过去一个月时间内,公司正在临床II期试验阶段的一类新药PI3K/HDAC双靶点抑制剂BEBT-908和进入临床II期试验阶段的一类新药CDK4高选择性CDK4/6抑制剂BEBT-209获得国家药监局颁发的4个新适应症共计5个临床批文。
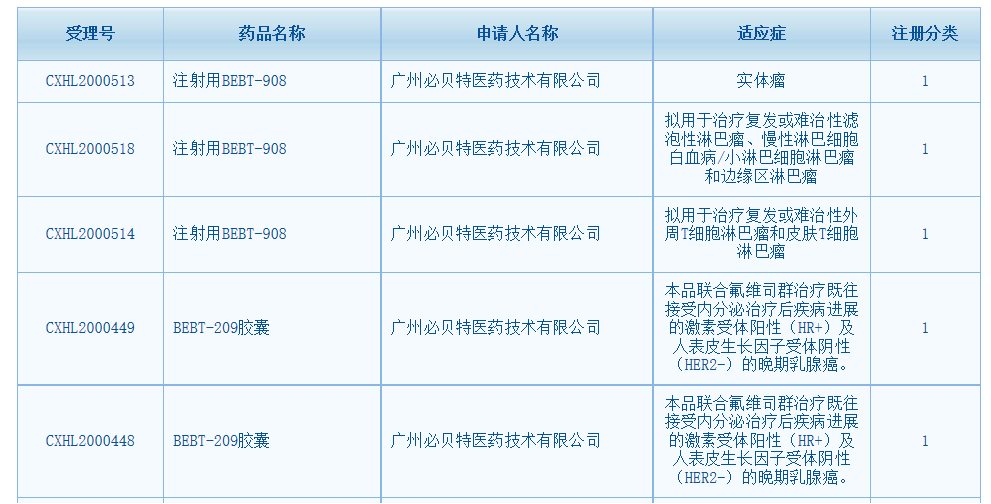
此外,公司自主研发的国内外首个泛-EGFR突变抑制剂BEBT-109分别于2020年3月和10月再获国家药监局药审中心同意,开展治疗EGFR外显子20插入和其它EGFR少见突变非小细胞肺癌的两项临床试验。目前,BEBT-109治疗T790突变、外显子20插入突变和其它EGFR少见突变非小细胞肺癌的三项Ib临床试验正在进行中。
最近,必贝特医药在北京召开了BEBT-908和BEBT-209两场临床试验方案研讨会。
BEBT-908多个适应症II期临床试验方案研讨会由中国抗癌协会淋巴瘤专业委员会主任委员、中国医学科学院肿瘤医院副院长石远凯教授主持,24家临床试验中心共一百多专家和机构负责人现场或视频参会。石教授和临床专家高度肯定BEBT-908治疗复发难治弥漫大B细胞淋巴瘤(r/rDLBCL)的II期临床试验早期结果,认为BEBT-908有望加速上市成为治疗r/rDLBCL的有效药物。参会专家还对即将开展的新增的BEBT-908治疗非霍奇金淋巴瘤的2个II期临床试验方案和治疗晚期实体瘤的1个Ib/II期临床试验方案提出了意见和建议。
BEBT-209联合来曲唑和BEBT-209联合氟维司群治疗乳腺癌的两个II期和III期临床试验方案研讨会由国家新药(抗肿瘤)临床研究中心主任、中国医学科学院肿瘤医院徐兵河教授主持,全国20多家临床试验中心共数十位多专家和机构负责人现场或视频参会。湖南省肿瘤医院欧阳取长教授(I期临床试验联合主PI)报告了I期临床试验安全性和初步药效学结果。与会专家们对BEBT-209 I期临床试验目前获得安全性和初步药效学结果给予了积极评价,并对该项目后续两个II/III期临床试验方案提出了宝贵的意见和建议。
必贝特医药董事长钱长庚博士代表申办方对参加BEBT-908临床试验方案研讨会的主PI单位石教授和参与该项研究的各中心专家和医护人员、对参加BEBT-209临床试验方案研讨会的主PI单位徐教授和参与该项研究的各中心专家和医护人员表示衷心感谢。这两个项目启动以来,大家共同努力,克服了新冠疫情影响,并取得了非常好的临床试验结果,极大增加了申办方和两个临床研究团队的信心。
必贝特医药专注一类新药研发,坚持自主创新,通过八年多的不懈努力,建立了包含5个处于临床试验阶段、3个处于临床申报阶段和2个处于临床前阶段的一类新药管线,其中BEBT-908、BEBT-260和BEBT-305有潜力成为First-in-Class新药。



 粤公网安备44011202003231号
粤公网安备44011202003231号